La plateforme DImaCell met à votre disposition équipements et compétences pour l'imagerie des interaction moléculaires :
- Mesures de durée de vie de fluorescence (Fluorescence Lifetime Imaging microscopy)
- Spectroscopie de corrélation de fluorescence (Fluorescence Correlation Spectroscopy -FCS)
- Suivi du recouvrement de fluorescence après photoblanchiement (Fluorescence Recovery After Photobleaching - FRAP)
- Suivi de particules uniques (Single Particles Tracking - SPT)
- Mesures d'anisotropie de fluorescence
Introduction aux techniques de fluorescence pour l'étude des interactions moléculaires :
- La mesure de durée de vie de fluorescence (Fluorescence Lifetime Imaging microscopy)
Le temps de vie de fluorescence d’une molécule est une caractéristique photophysique qui va varier de la picoseconde à la nanoseconde selon les interactions avec le milieu environnant. Les mesures de durée de vie permettent ainsi de sonder les interactions locales au sein des cellules vivantes à l’aide de sondes fluorescentes. Une application majeure du FLIM est la détection du FRET (Förster Resonant Energy Transfer) qui est un transfert d’énergie non radiatif entre des molécules distantes de quelques nanomètres. Les mesures de durée de vie de fluorescence sont possibles en microscopie (multiphoton ou confocale) ou en spectroscopie (mesures en cuvette).
Equipements associés : Microscope multiphoton, Spectromètre Fluoromax 4.
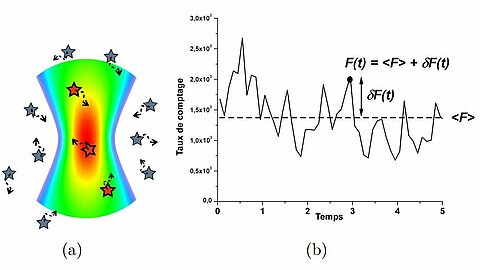
- La spectroscopie de corrélation de fluorescence (Fluorescence Correlation Spectroscopy - FCS)
Cette technique repose sur l'analyse par auto (ou cross) corrélation)) des fluctuations de l'intensité de la fluorescence dans le volume observé. L'analyse donne accès aux paramètres physiques gouvernant ces fluctuations. Elle permet par exemple d'obtenir le nombre moyen de particules dans le volume d'observation mais aussi le temps de diffusion moyen. On peut ainsi déterminer par exemple la concentration, la taille des particules présentes, ou encore la viscosité de l'environnement local.
Equipements associés : Microscope multiphoton, microscope confocal.
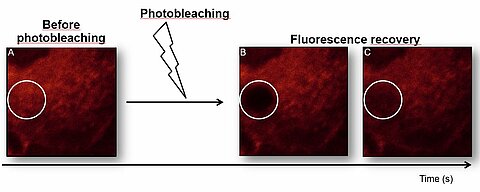
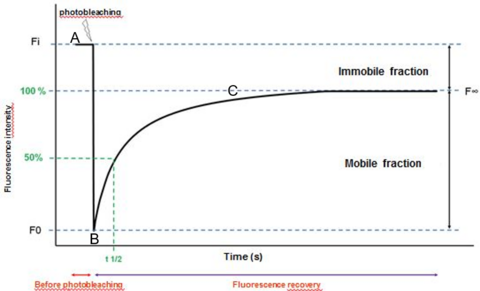
- Le recouvrement de fluorescence après photoblanchiement (Fluorescence Recovery After Photobleaching - FRAP)
Cette technique repose sur la photodégradation de la zone à étudier par un pulse laser court et intense. On mesure alors la fluorescence produite par le retour des molécules non blanchies diffusant dans la région affectée. L’analyse de cette cinétique de retour de fluorescence permet de caractériser la diffusion dans le milieu étudié par la mesure du coefficient de diffusion D, ainsi que la fraction mobile et immobile du fluorophore utilisé. Le FRAP procure une information moyennée sur la taille du volume photoblanchi, sa résolution spatiale est généralement de l’ordre du micromètre. C’est une technique nécessitant un fort marquage des échantillons et l’emploi de puissances laser assez élevées, le processus est donc relativement invasif.
Equipements associés : Microscope multiphoton, microscope confocal.
- Le suivi de particules uniques (Single Particles Tracking - SPT)
L’imagerie de molécule unique, ou SPT pour Single Particule Tracking, est une technique de suivi du mouvement de molécules fluorescentes individuelles à l’aide d’un système d’imagerie rapide. Un petit nombre des molécules dont on souhaite étudier le mouvement est marqué par une sonde très brillante et stable. On enregistre ensuite la trajectoire de ces particules individuelles marquées. Cette technique est très appréciée pour l’étude de la diffusion dans les membranes cellulaires, où une même molécule peut y exhiber différents types de mouvements : diffusion brownienne, transport actif, diffusion contrainte ou même immobilisation. La résolution spatiale peut atteindre une dizaine de nanomètres et la résolution temporelle quelques dizaines de microsecondes. Le SPT peut être comblinée avec la miicroscopie super-résolue PALM, permettant d'imager des échantillons à une ou deux couleurs avec une résolution de 40 nm environ.
Equipement associé : Microscope super-résolu PALM/STORM.
- L’anisotropie de fluorescence
L’anisotropie de fluorescence est l’une des méthodes de mesure de fluidité les plus utilisées en biologie. Elle repose sur la mesure de la dépolarisation du signal de fluorescence émis par des molécules excitées par une lumière polarisée. La rotation par diffusion des fluorophores est la principale raison de cette dépolarisation, la vitesse de rotation dépendant de la taille des molécules et de la viscosité du milieu.
DImaCell permet de mesure l'anisotropie de fluorescence en spectroscopie (mesure d'ensemble).
Equipements associés : Spectrofluorimètre Fluorolog 3 (détection en T), Spectrofluorimètre Fluoromax 4 (détection en L).
Exemples de réalisation
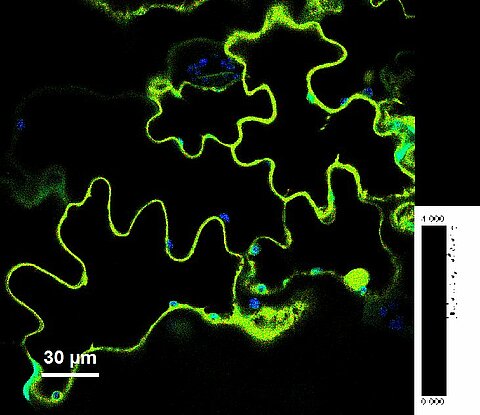
Cellules végétales en FLIM
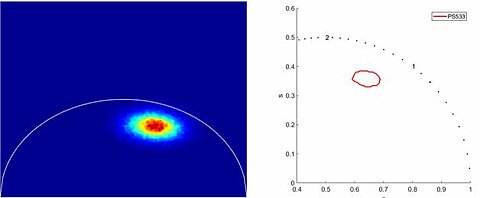
FLIM - Analyse Phasor
FLIM- Histogramme TCSPC
FLIM - Spores bactériennes
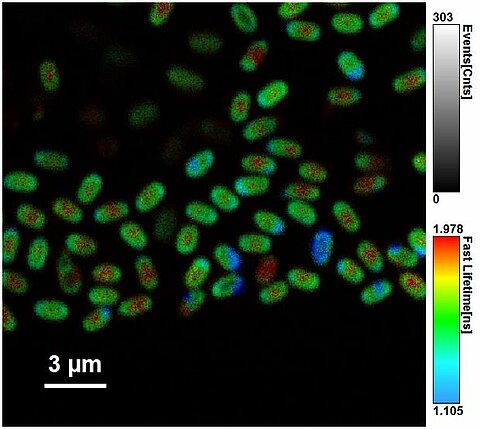
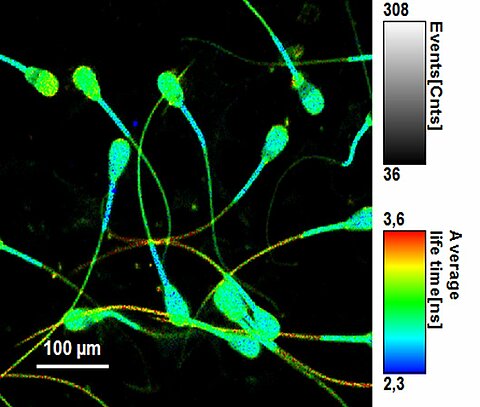
FLIM - Spermatozoides bovins
FRAP - analyse
FRAP sur cellules végétales